規格ISO 18562 シリーズの最新情報
医療機器の呼吸ガス経路の生体適合性評価に関する最新版ガイダンスとして、ISO 18562:2024 (第2版) が発行されました。

2024年5月6日
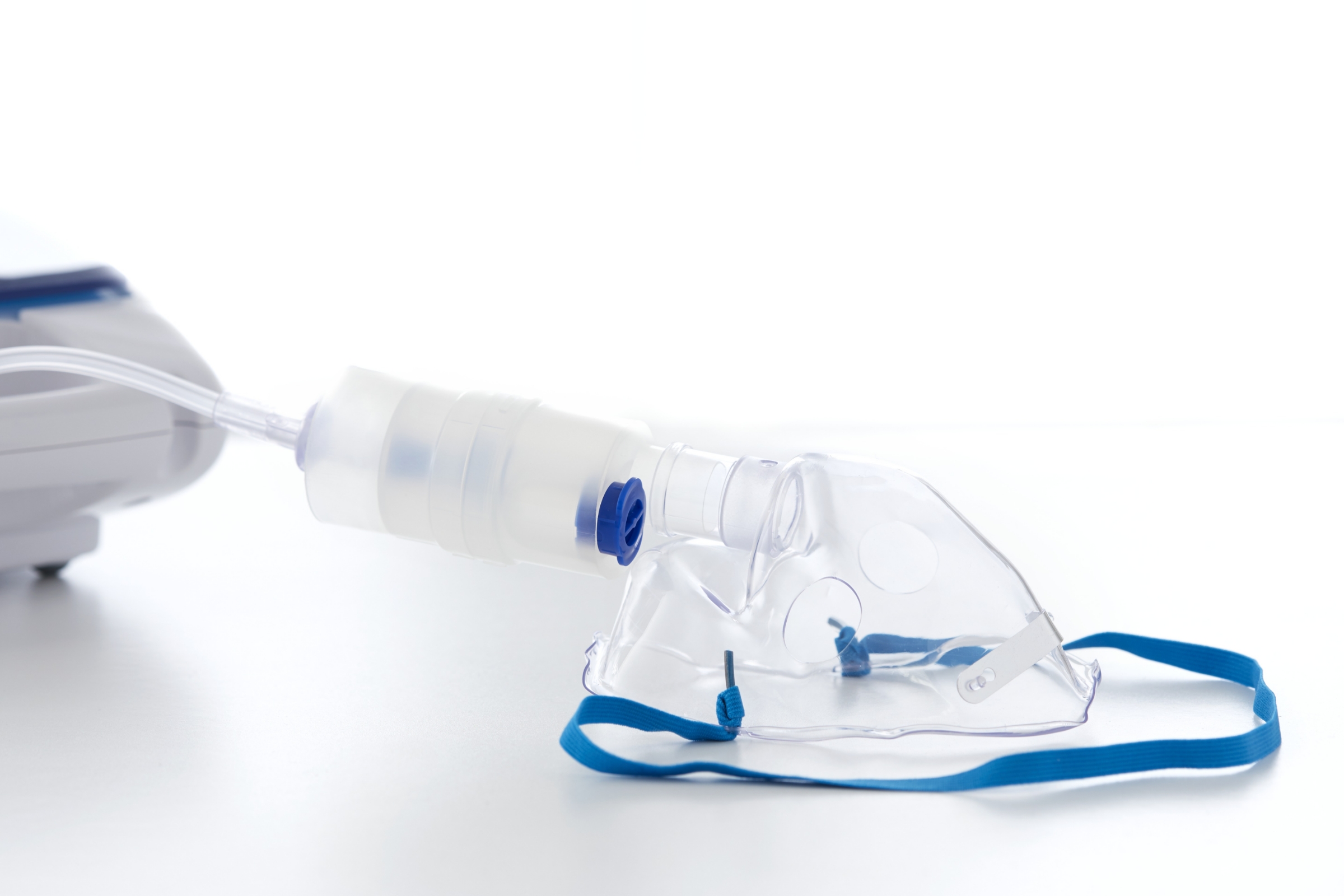
呼吸ガス経路のある医療機器の生体適合性評価は、患者の健康と安全に対する潜在的リスクを評価するために必要なプロセスであると同時に、複雑なプロセスと言えます。その中で、あらゆる種類の呼吸ケアで用いられる医療機器および部材を対象として、吸入ばく露に特化したリスクを評価・試験するための手順を示した規格ISO 18562 シリーズが2017年3月に導入されました。
このISO 18562 シリーズは、呼吸ケアに用いられる医療機器、および麻酔薬などの物質を呼吸器系へ供給する医療機器について、その呼吸ガス経路の生体適合性評価に関する一般原則を示した規格となっています。新しい医療機器は、米国食品医薬品局 (FDA) への510(k) 申請や欧州医療機器規則 (EU MDR) への準拠においてISO 18562 シリーズに基づく評価・試験が必要となります。既存製品は材料変更の評価において、同じくISO 18562 シリーズに基づく評価・試験が必要となります。
昨今、吸入ばく露の危険性に関連して数件のリコールが発生したことを受けて、世界中の規制当局は呼吸ガス経路のある医療機器の ISO 18562 評価に注目しています。
2017年の初版以降に得られた教訓に基づき、最新のガイダンスとして、以下の4つのパートで構成されるISO 18562 シリーズの改訂版が発行されました。
- ISO 18562-1 – Part 1 リスクマネジメントプロセスにおける評価及び試験
- ISO 18562-2 – Part 2 粒子状物質の放散試験
- ISO 18562-3 – Part 3 揮発性有機化合物 (VOC) の放散試験
- ISO 18562-4 – Part 4 結露中の浸出物の試験
改訂版では、医療機器の想定耐用期間中に起こり得る劣化による分解副生成物の評価に重点が置かれています。UL Solutionsは生体適合性評価のリーディングカンパニーとして、製造業者の皆さまに、呼吸・換気装置およびそれらの付属品に関する世界各国の法令順守に対応した試験および毒性評価サービスを提供しています。弊社の試験サービスは、製品ライフサイクルのさまざまな時点に対応可能です。劣化試験、化学分析、毒性ばく露評価に対応した世界各国の試験所で製品に応じた試験を計画および実施し、医療機器製造業者の皆さまをサポートいたします。
UL Solutionsは長年にわたって世界の呼吸装置製造業者へ試験とばく露評価サービスを提供しています。呼吸ガス経路を備えた医療機器のISO 18562 シリーズに基づく評価において、弊社の包括的なアプローチは高い評価をいただいています。